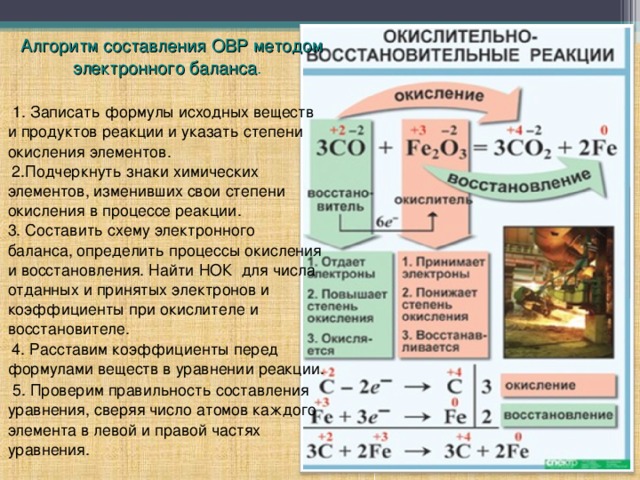
Данный материал включает план урока и презентацию на тему " Степень окисления. Окислительно- восстановительные реакции". Урок для 8 класса, хотя его и презентацию можно использовать и в 9 классе, когда необходимо повторить алгоритм составления окислительно- восстановительных реакций. Кроме того, презентацию целесообразно использовать при закреплении понятий " степень окисления", "окислитель", "восстановитель", " электронный баланс ". При наличии интерактивной доски учащимся можно предложить выполнить задания 4-го и 5-го слайдов самостоятельно, и тут-же быстро и наглядно их проверить. Задания соответствуют образовательному стандарту.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Урок и презентация к уроку "Степень окисления. Окислительно- восстановительные реакции"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Степень окисления,8класс»
Просмотр содержимого презентации
«ОВР»
Похожие файлы
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
2200 руб.
3140 руб.
1990 руб.
2840 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства