Методическая раработка по химии для студентов 1 курса,отделения 34.02.01.Сестринское дело
- Меню
- Главная
- Дошкольное образование
- Начальные классы
- Астрономия
- Биология
- География
- Информатика
- Математика
- Алгебра
- Геометрия
- Химия
- Физика
- Русский язык
- Английский язык
- Немецкий язык
- Французский язык
- История
- Естествознание
- Всемирная история
- Всеобщая история
- История России
- Право
- Окружающий мир
- Обществознание
- Экология
- Искусство
- Литература
- Музыка
- Технология (мальчики)
- Технология (девочки)
- Труд (технология)
- Физкультура
- ИЗО
- МХК
- ОБЗР (ОБЖ)
- Внеурочная работа
- ОРК
- Директору
- Завучу
- Классному руководителю
- Экономика
- Финансовая грамотность
- Психологу
- ОРКиСЭ
- Школьному библиотекарю
- Логопедия
- Коррекционная школа
- Всем учителям
- Прочее
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Учебное пособие по оргнической химии
Просмотр содержимого документа
«Учебное пособие по оргнической химии»
| Шенталинский филиал государственного бюджетного профессионального образовательного учреждения «Тольяттинский медицинский колледж»
Учебно методическое пособие
по дисциплине ОУД 12. «ХИМИЯ»
Раздел 3 «Этиленовые и диеновые углеводороды. Каучуки».
Тема 3.1 Гомологический ряд алкенов. Изомерия и номенклатура. Тема 3. 2 Получение и химические свойства алкенов. Тема 3.3.Диеновые углеводороды. Тема 3.4.Получение этилена изучение его свойств. \ Тема 3.5.Гомологический ряд алкинов.
Курс 1
Специальность 34.01.02. Сестринское дело
Шентала,2021 год
| |
| Рассмотрено и утверждено на заседании ЦМК «Общих гуманитарных, социально-экономических, математических и естественнонаучных дисциплин» Протокол № ________от «____»______________20___г. Председатель ЦМК Мутыгуллина М.Б.._______
| Составлено в соответствии с Федеральными требованиями к минимуму содержания и уровню подготовки выпускников по специальности 34.02.01. Сестринское дело Зав. отделом по УР «____»____________20___ г. ________________Е.В. Курганская
|
| Методист ------------------- Богданова А.Д. «--- »---------2021г. | |
Составитель:
Серикова Т.Н. – преподаватель высшей квалификационной категории ГБПОУ ТМедК «Тольяттинский медицинский колледж»
Содержание.
| №п\п | Наименование | Стр. |
| 1 | Пояснительная записка
| 4-6 |
| 2 | Тема 3.1 Гомологический ряд алкенов. Изомерия и номенклатура.
| 7-12 |
| 3 | Тема 3.2. Получение и химические свойства алкенов.
| 13-17 |
| 4 | Тема 3.3. Диеновые углеводороды
| 18-25 |
| 5 | Тема 3.4. Получение этилен , изучение его свойств.
| 26-28 |
| 6 | Задание по теме Диены. Каучук.
| 29-31 |
| 7 | Тема 3.5. Гомологический ряд алкинов.
| 32-37 |
| 8 | Приложение 1. Правила составления названий алкенов по международной номенклатуре (ИЮПАК)
| 38 |
| 9 | Приложение 2 Гомологический ряд алкенов | 39 |
| 10 | Приложение 3. Структурные формулы алкенов | 40 |
| 11 | Приложение 4. Применение алкенов в медицине, в промышленности. | 41 |
| 12 | Приложение 5. Применение диеновых углеводородов в медицине. | 22 |
| 13 | Приложение 6 Задания для самостоятельной работы студентов. | 41-42 |
| 14 | Приложение 7. Контрольная работа по теме - «Непредельные углеводороды».
| 43-46 |
| 15 | Рекомендуемая литература. | 47 |
Пояснительная записка.
Учебно методическое пособие разработано в соответствии с ФГОС СПО по дисциплине ОУД 12. «Химия» и предназначено для преподавателей и студентов I курса специальности 34.02.01 «Сестринское дело».
В соответствии с тематическим планом дисциплины учебно методическое пособие рассчитано на 10 часов теоретических занятий.
Основной учебной целью предлагаемого пособия является формирование прочных знаний по органической химии. Одновременно продолжается развитие умений самостоятельно работать с литературой, систематически заниматься решением задач, работать с тестами различных типов. Полученные знания закрепляются серией упражнений, задач, тестов.
В процессе освоения дисциплины у студентов должны формироваться общие компетенции (ОК) в рамках федерального компонента государственного образовательного стандарта среднего полного общего образования в пределах ОПОП СПО по естественнонаучному профилю:
ОК -1 - Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2 – организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их выполнение и качество;
ОК 3 – принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность;
ОК 4 – осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития;
ОК 5 – использовать информационно – коммуникационные технологии в профессиональной деятельности;
ОК 6 – работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями;
ОК 7 – брать на себя ответственность за работы членов команды (подчинённых), за результат выполнения заданий;
ОК 8 – самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать и осуществлять повышение квалификации;
Задачи учебно методического пособия:
образовательные:
Изучив раздел студент должен:
Знать:
классификацию и номенклатуру предельных углеводородов;
гомологический ряд алкенов;
классификацию диеновых углеводородов;
номенклатуру диеновых углеводородов;
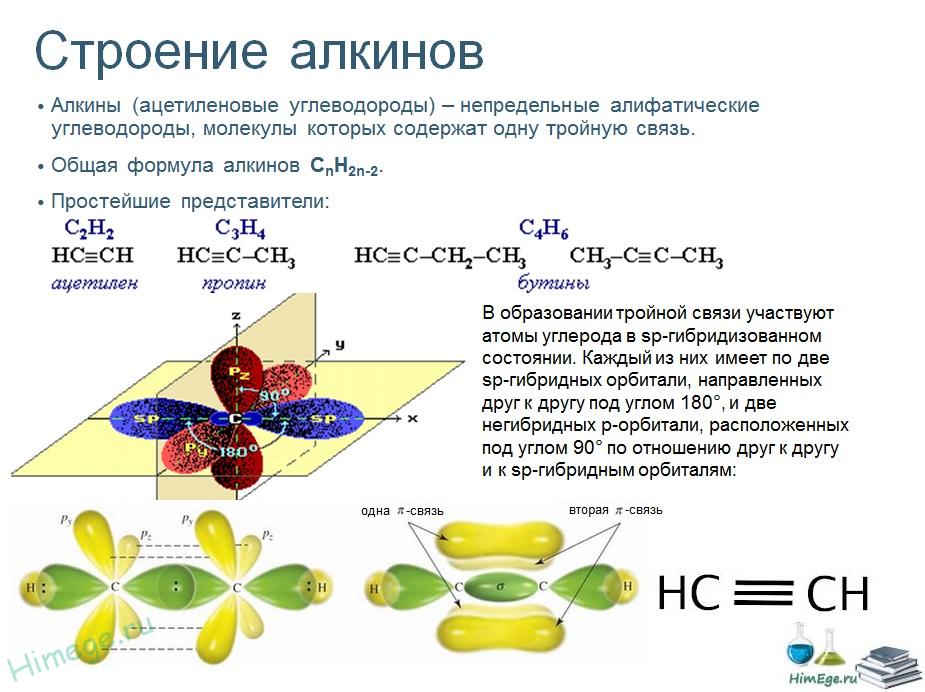
гомологический ряд алкинов, номенклатуру ацетиленовых углеводородов.
Ориентироваться:
в основных понятиях;
изомерии;
в реакциях: гидрирование (дегидрирование),галогенирование (дегалогенирование),хлорирование (дехлорирование).гидратация (дегидратация).гидрохлорирование.
Уметь:
называть: непредельные углеводороды по «тривиальной» или международной номенклатурам;
определять: пространственное строение молекул, изомеры и гомологи; характер взаимного влияния атомов в молекулах непредельных углеводородов;
характеризовать: строение непредельных углеводородов; их общие химические свойства;
объяснять: зависимость реакционной способности непредельных углеводородов от строения их молекул;
выполнять химический эксперимент по распознаванию важнейших непредельных углеводородов;
проводить расчеты по химическим формулам и уравнениям реакций.
развивающие:
продолжить развитие исследовательской компетентности студентов:
через поиск необходимой информации в учебной, дополнительной литературе, Интернете;
развивать умение работать со схемами, рисунками, слайдами презентации;
развивать умение сравнивать (на примере сравнения различных классов углеводородов);
умение анализировать (умения выдвигать гипотезу на основе мысленного эксперимента для ответа на вопросы проблемного характера);
развивать творческие способности студентов с помощью самостоятельной работы по переносу полученных знаний и умений в новую ситуацию;
воспитательные:
развивать коммуникативные способности студентов при работе в парах, в группе;
воспитывать культуру умственного труда - развивать внутреннюю мыслительную активность и самостоятельность;
активность и самостоятельность;
Целью и основными задачами организации и осуществления самостоятельной работы студентов является:
систематизация и закрепление полученных теоретических знаний и практических умений;
углубление и расширение теоретических знаний;
формирование общих компетенций;
формирование умений использовать специальную и дополнительную литературу, периодическую печать;
развитие познавательных способностей и активности обучающихся;
формирование самостоятельности мышления;
развитие исследовательских умений.
межпредметные:
использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
предметные:
сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
владение правилами техники безопасности при использовании химических веществ;
сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
В учебно методическое пособие раздела входят следующие материалы: лекционный материал теоретического занятия, методические разработки практических занятий, разно уровневые задания для самостоятельной работы студентов.
Оборудование и наглядные пособия: компьютер, экран, мультимедийный проектор, комплекты опорных конспектов, презентация «Непредельные углеводороды».
https://infourok.ru/prezentaciya_po_himii_na_temunepredelnye_uglevodorody-527719.htm
Раздел 3. «Этиленовые и диеновые углеводороды. Каучуки».
Материал к теме:
Тема 3.1. Гомологический ряд алкенов. Изомерия и номенклатура.
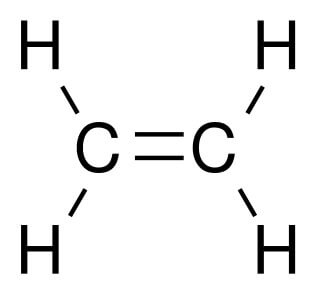
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкенов.
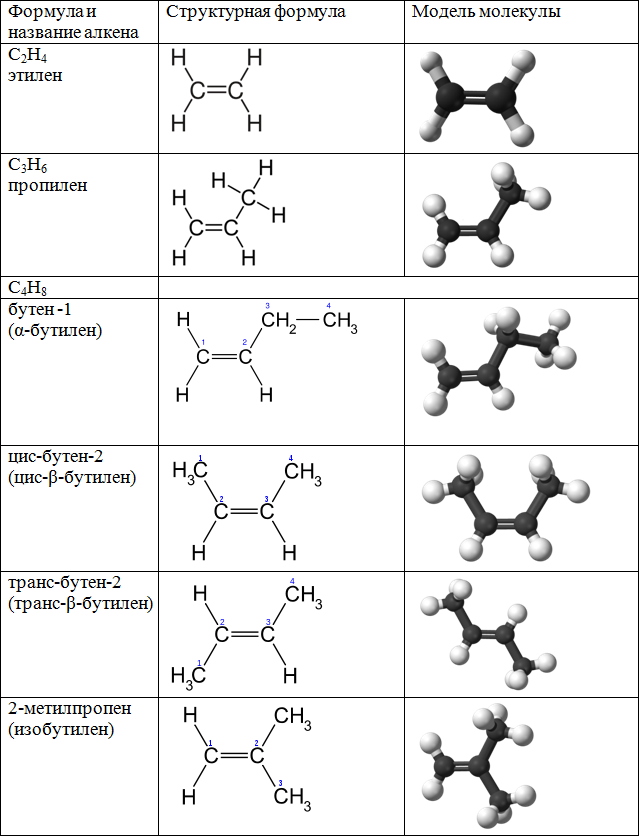
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу – СН2– в углеводородную цепь.
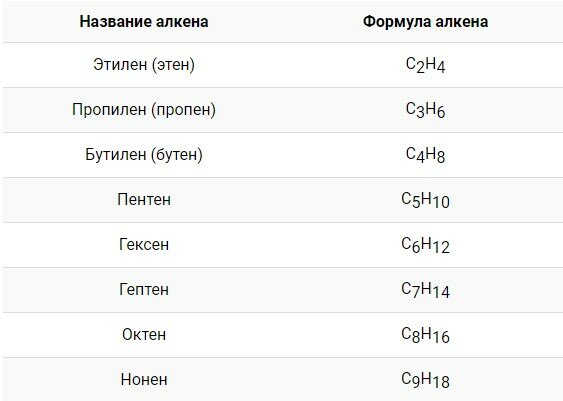
Гомологический ряд алкенов
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
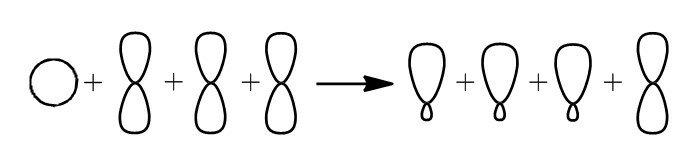
sp2-гибридизация
При образовании σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:

Сигма-связь
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
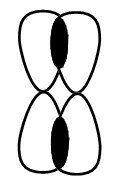
пи-Связь
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120 градусов друг к другу:
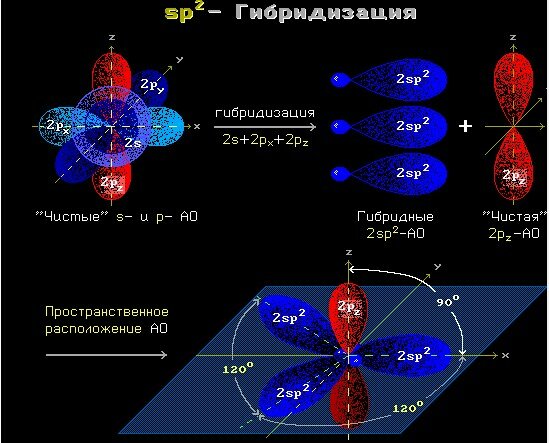
Это соответствует плоско-треугольному строению молекулы.
Например, молекуле этилена C2H4 соответствует плоское строение.
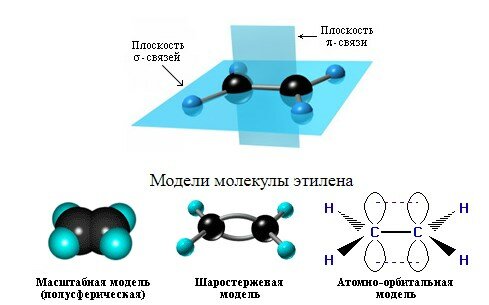
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропилена присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи.
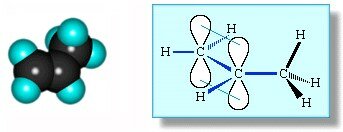
Изображение с сайта orgchem.ru
Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры - это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Например.
Изомеры с различным углеродным скелетом и с формулой С4Н8 - бутен-1 и метилпропен
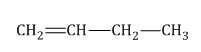
Бутен-1
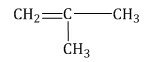
Метилпропен
Межклассовые изомеры - это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов -CnH2n.
Например.
Межклассовые изомеры с общей формулой С3Н6 - пропилен и циклопропан
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
Например.
Изомеры положения двойной связи, которые соответствуют формуле С4Н8 - бутен-1 и бутен-2.
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связиразличные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Например.
Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере метильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере - по разные стороны.
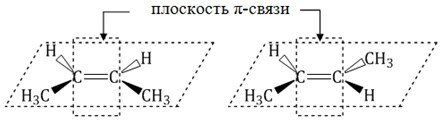
цис-транс-Изомерия
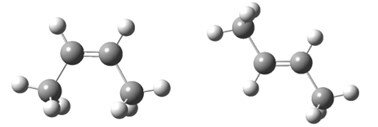
цис-транс-Бутен-2
Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковыхсоседних атома.
Например.
Для пентена-1 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода).
Номенклатура алкенов
В названиях алкенов для обозначения двойной связи используется суффикс -ЕН.
Например, алкен имеет название метилпропен.

Метилпропен
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами:
1. Углеродная цепь, в составе которой есть двойная связь, считается главной.
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи.
3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи.
4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
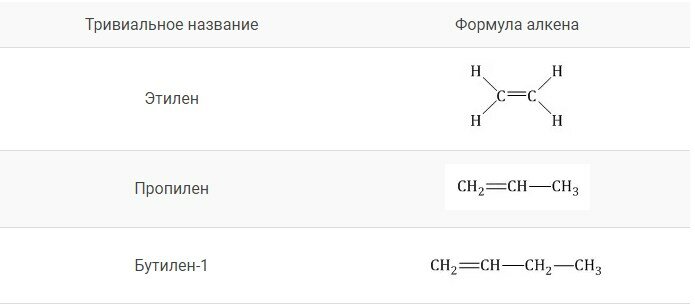
Тривиальные названия алкенов
Радикалы, содержащие двойную связь, также носят тривиальные названия:
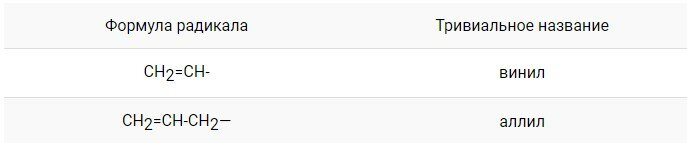
Названия радикалов алкенов
Материал к теме:
Тема 3. 2. Получение и химические свойства алкенов.
1. Способы получения алкенов
Составить уравнения реакций, подтверждающих способы получения алкенов
– крекинг алканов C8H18 –– C4H8 + C4H10; (термический крекинг при 400-700 oС)
октан бутен бутан
– дегидрирование алканов C4H10 –– C4H8 + H2; (t, Ni)
бутан бутен водород
– дегидрогалогенирование галогеналканов C4H9Cl + KOH –– C4H8 + KCl + H2O;
хлорбутан гидроксид бутен хлорид вода
калия калия
– дегидрогалогенирование дигалогеналканов 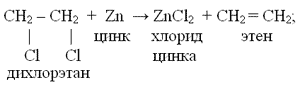
– дегидратация спиртов С2Н5ОН –– С2Н4 + Н2О (при нагревании в присутствии концентрированной серной кислоты)
Запомните! При реакиях дегидрирования, дегидратации, дегидрогалогенирования и дегалогенирования нужно помнить, что водород преимущественно отрывается от менее гидрогенизированных атомов углерода (правило Зайцева, 1875 г.)
2. Химические свойства алкенов.
Характер углерод – углеродной связи определяет тип химических реакций, в которые вступают органические вещества. Наличие в молекулах этиленовых углеводородов двойной углерод – углеродной связи обуславливает следующие особенности этих соединений:
– наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения олефинов;
– двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер;
– двойная связь состоит из одной ![]() - и одной
- и одной ![]() -связи, которая достаточно легко поляризуется.
-связи, которая достаточно легко поляризуется.

Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.
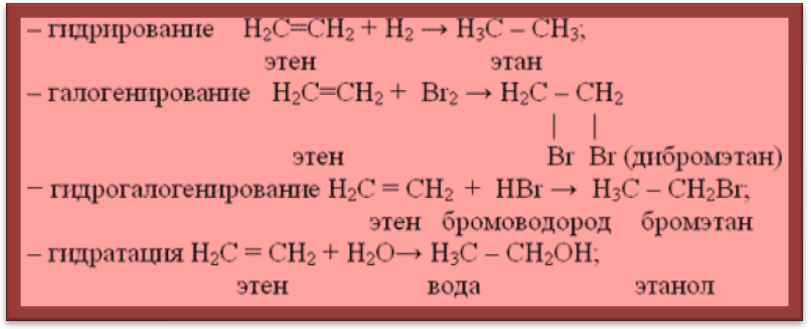
Запомни! Возможны следующие механизмы разрыва ![]() -связи:
-связи:
а) если алкены и реагент – неполярные соединения, то ![]() -связь разрывается с образованием свободного радикала:
-связь разрывается с образованием свободного радикала:
H2C = CH2 + H : H –– [H2C· – CH2·] + [H·] + [H·]
б) если алкен и реагент – полярные соединения, то разрыв ![]() -связи приводит к образование ионов:
-связи приводит к образование ионов:
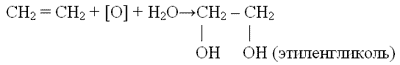
в) при соединении по месту разрыва ![]() -связи реагентов, содержащих в составе молекулы атомы водорода, водород всегда присоединяется к более гидрированному атому углерода (правило Морковникова, 1869 г.).
-связи реагентов, содержащих в составе молекулы атомы водорода, водород всегда присоединяется к более гидрированному атому углерода (правило Морковникова, 1869 г.).
– реакция полимеризации nCH2 = CH2 –– n – CH2 – CH2 –– (– CH2 – CH2 –)n
этен полиэтилен
б) реакция окисления
Лабораторный опыт. Получить этилен и изучить его свойства ( инструкция на столах учащихся)
Инструкция по получению этилена и опытов с ним
1. Поместите в пробирку 2 мл концентрированной серной кислоты, 1 мл спирта и небольшое количество песка.
2. Закройте пробирку пробкой с газоотводной трубкой и нагрейте в пламени спиртовки.
3. Выделяющийся газ пропустите через раствор с перманганатом калия. Обратите внимание на изменение цвета раствора.
4. Подожгите газ у конца газоотводной трубки. Обратите внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
C2H4 + 3O2 –– 2CO2 + 2H2O (при полном окислении продуктами реакции являются углекислый газ и вода)
Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)
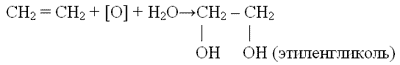
При более жёстких условиях в кислой среде продуктами реакции могут быть карбоновые кислоты, например (в присутствии кислот):
CH3– CH = CH2 + 4 [O] –– CH3COOH + HCOOH
– каталичесикое окисление
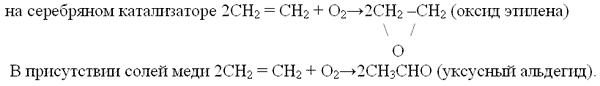
Запомните главное!
1. Непредельные углеводороды активно вступают в реакции присоединения.
2. Реакционная активность алкенов связана с тем, что ![]() - связь под действием реагентов легко разрывается.
- связь под действием реагентов легко разрывается.
3. В результате присоединения происходит переход атомов углерода из sp2 – в sp3- гибридное состояние. Продукт реакции имеет предельный характер.
4. При нагревании этилена, пропилена и других алкенов под давление или в присутствии катализатора их отдельные молекулы соединяются в длинные цепочки – полимеры. Полимеры (полиэтилен, полипропилен) имеют большое практическое значение.
3. Применение алкенов.
1 – получение горючего с высоким октановым числом;
2 – пластмасс;
3 – взрывчатых веществ;
4 – антифризов;
5 – растворителей;
6 – для ускорения созревания плодов;
7 – получение ацетальдегида;
8 – синтетического каучука.



Материал к теме:
Тема 3.3.Диеновые углеводороды.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Приложение 1
Правила составления названий алкенов по международной номенклатуре (ИЮПАК)
1.Найти наиболее длинную (главную) цепь углеродных атомов, которая содержит двойную связь и наибольшее число заместителей (ответвлений).
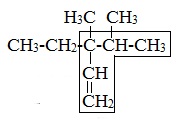
2. Пронумеровать атомы углерода главной цепи так, чтобы атом «С», у которого начинается двойная связь, имел наименьший номер.
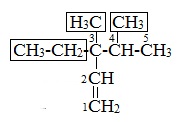

3. Назвать заместители (алкильные радикалы) в алфавитном порядке и алкен, соответствующий главной цепи.
4. Цифрой указать положение двойной связи после названия главной цепи.
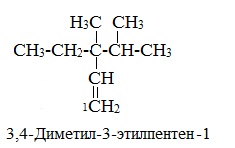
Примеры

Приложение 2
Гомологический ряд алкенов.
Арабской цифрой в конце названия через дефис обозначают номер углерода, от которого начинается двойная связь.
| Алкан | Название | Алкен | Название |
| C2H6
| этан | C2H4 | этен (этилен) |
| C3H8
| пропан | C3H6 | пропен (пропилен) |
| C4H10
| бутан | C4H8 | бутен-1 |
| C5H12
| пентан | C5H10 | пентен-1 (амилен) |
| C6H14
| гексан | C6H12 | гексен-1 (гексилен) |
| C7H16
| гептан | C7H14 | гептен-1 (гептилен) |
| C8H18
| октан | C8H16 | октен |
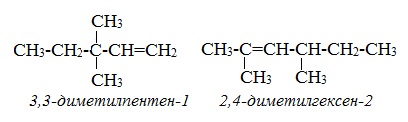
Приложение 3
Формулы названия алкенов.
Приложение 4.
Применение алкенов в медицине.
Большое практическое значение имеют продукты реакции алкенов. Многие из них используются в медицине. Из пропена получают глицерин. Этот многоатомный спирт является прекрасным растворителем, причем, если его использовать вместо воды, растворы будут более концентрированными. В медицинских целях в нем растворяют алкалоиды, тимол, йод, бром и др. Также глицерин применяют при приготовлении мазей, паст и кремов. Он предотвращает их высыхание. Сам по себе глицерин является антисептиком.
При реакции с хлороводородом получаются производные, которые применяются как местная анестезия при нанесении на кожу, а также для кратковременного наркоза при незначительных хирургических вмешательствах, при помощи ингаляций.
Алкадиены — это алкены с двумя двойными связями в одной молекуле. Основное их применение — производство синтетического каучука, из которого потом изготавливают различные грелки и спринцовки, зонды и катетеры, перчатки, соски и многое другое, что просто незаменимо при уходе за больными.
Применение алкенов в промышленности.
| Вид промышленности | Что применяют | Каким образом могут использовать |
| Сельское хозяйство | этен | ускоряет созревание овощей и фруктов, дефолиация растений, пленки для теплиц |
| Лако-красочная | этен, бутен, пропен и др. | для получения растворителей, эфиров, сольвента |
| Машиностроение | 2-метилпропен, этен | производство синтетического каучука, смазочные масла, антифриз |
| Пищевая промышленность | этен | производство тефлона, этилового спирт, уксусная кислота |
| Химическая промышленность | этен, полипропилен | получают спирты, полимеры (поливинилхлорид, полиэтилен, поливинилацетат, полиизобтилен, уксусный альдегид |
| Горная промышленность | этен и др. | взрывчатые вещества |
Приложение 5.
Применение диеновых углеводородов в медицине.
Применение в медицине и фармации
Полиэтилен по-разному используется в фармации, во-первых, для изготовления упаковочных изделий (флаконов, шприцев, капельниц, пробок и др.) во-вторых, как скелетоутворювальний материал для матрицы в производстве таблеток.
Полиэтилен высокого давления с вазелиновым маслом является мазевой основой ( «Plastibas»). Композиции полиэтилена с вазелиновым маслом или полипропилена с минеральным маслом в определенных концентрациях ( «Plastibasе», «Selene», «Plastonite», «Sguile») пригодны для приготовления мазей с ихтиолом, дегтем, перуанским бальзамом и др. Изобутилен - сырье для получения бутилкаучука, изопрена, трет-бутилового спирта; его используют для алкилирования фенолов при синтезе ПАВ. α-олефины состава С10-С18 задействованы в синтезе ЮАР, а также в получении высших спиртов.
:
Приложение 6
Задания для самостоятельной работы студентов.
Какие соединения называют непредельными? Чем их состав отличается от состава предельных углеводородов. Приведите примеры.
.Подчеркните формулы веществ, которые можно отнести к алкенам: С4Н8, СН4, С5Н12, С2Н4, С3Н4, С7Н16, СН2, С6Н6, С8Н16, С5Н10.
3.) Составьте структурные формулы следующих веществ:
а) 2-метилбутен-1; б) 3,3-дибромпентен-1
4.) Дайте название веществам:
а) СН3-СН = СН-СН3 б) СН2=СН-СН2-СН2-СН2-СН3
5) Составьте структурные формулы следующих веществ:
а) пентен-1; б) 2,3-диметилгексен-1
6) Дайте названия следующим веществам:
а) СН3-СН2-С=СН-СН2-СН3 б) СН2=СВr – CHBr –CH3
СН3
7). Двойная связь в алкенах состоит из:
А) одной сигма- и одной пи- связи
Б) двух пи-связей
В) двух сигма-связей
Г) верного ответа среди перечисленных нет
8). Назовите непредельный углеводород.
СН2
||
СН3 – СН2 – СН2 – С– СН2 – СН3
Эталон ответа: (2- этилпентен-1)
9) Напишите структурные формулы веществ:
а) 3-метилпентен-1 б) 2,2-диметил-3-этилгептен-3 в) 2-метилоктен-2
г) 2-метил-4-этилгексен-2 д) 3-метилпентен-2 е) 3-метилгексен-2
ж) циклогексан з) цис-изомер-гексен-2
10). Напишите структурные формулы алкенов состава С5Н10 и дайте им названия.
Эталон ответа:

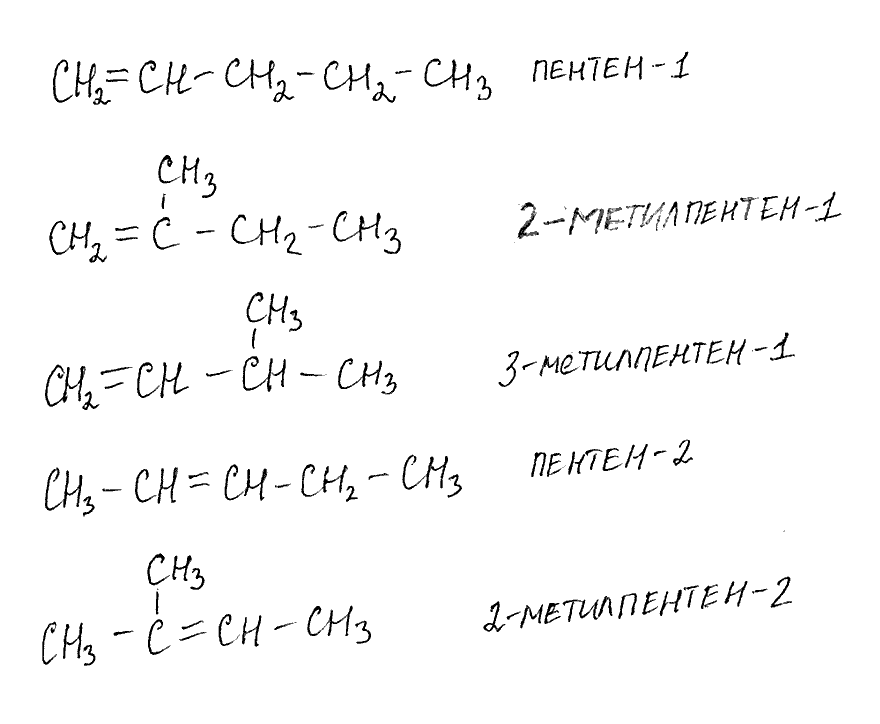
11). Напишите структурные формулы следующих алкенов:
алкенов:
а) 2,3,4-триметилпентен-1; б) 4,5-диметил-3-этилгексен-2.
Эталон ответа:
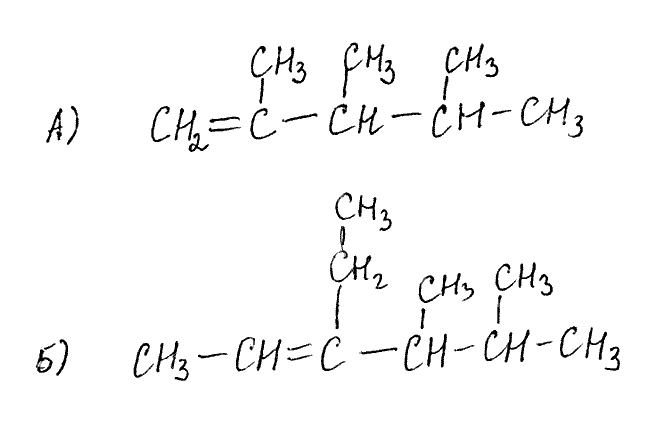
Приложение 7.
Контрольная работа по теме непредельные углеводороды.
Задания для самостоятельной работы студентов.
Вариант 1
1) Как называется вещество: СН3 – СН – СН = СН – СН3
|
СН3
а) н – гексан; б) 2 – метилпентен – 3;
в) 4 – метилпентен – 2; г) нет верного ответа
2) Какое из данных веществ не является изомером пентена – 1:
а) СН3 – СН = СН – СН2 – СН3; б) СН3 – С = СН – СН3 в) СН2___ СН2;
| | |
СН3 СН2 ___ СН – СН3
г) СН3 – СН2 – СН – СН3
│
СН3
Вариант 2
1) Какая структурная формула соответствует 3-метилгексену –2:
а) СН3 – СН – СН = СН ─ СН3; б) СН = С – СН2 – СН2 – СН3;
СН3 СН3 СН3
в) СН2 = СН – СН – СН3; г) СН3 – СН2 – СН2 – СН = С – СН3
СН3 СН3
Вариант 3
Cl
1) Дайте названию веществу: СН3 – С – СН = СН2
Сl
а) 2,2 – дихлорбутен – 3; б) 3,3 – дихлорбутен – 2;
в) 3,3 –дихлорбутен –1; г) 3 – хлорбутен – 1
Вариант 4
1) Какая структурная формула соответствует 2-метилпентену-2:
а) СН3 – СН – СН = СН – СН3 б) СН2 = С – СН2 – СН2 ─ СН3
СН3 СН3
в) СН3 – С = СН – СН3 г) СН3 – СН2 – СН = С – СН3
СН3 СН3
2. Основные положения теории химического строения сформулировал в 1861 году
1) Д.И. Менделеев
2) А.М. Бутлеров
3) Ф. Велер
4) В.В. Марковников
3. К соединению, имеющему общую формулу СnН2n, относится
гептан
гексан
гексен
гексин
4. К соединениям, имеющим общую формулу СnН2n+2, относится
бутен
гексен
этилен
нонан
Напишите графические формулы следующих алкенов: а) 3-этилгексен-1; б) 3-этил-2-метилоктен-4; в) 3-пропилгептен-1; г) 2-метил-3-пропилгептен-1; д) 5,6-диметил-4-пропилгептен-2; е) 2-метил-6-вторбутил-4-неопентил-2-децен.
Самостоятельная работа
Тема: Алканы, алкены, алкины. I вариант.
1.Составьте структурные формулы следующих веществ:
4- метилпентин-2; 3-этилпентен-2.
2.Укажите валентный угол, тип гибридизации углерода, общую формулу алкенов.
3.Выбери из этого списка формулы алканов:
C6H14, C8H16, C6H6, C3H6, C2H6O, C12H22O11, C5H12, C7H12.
4.Напишите уравнения реакций. Дайте названия получившимся веществам.
а) гидрирование пропена;
б) горение ацетилена;
в) бромирование пропина (первая стадия).
_________________________________________________________________________
Самостоятельная работа.
Тема: Алканы, алкены, алкины. III вариант.
1.Составьте структурные формулы следующих веществ:
4- метилпентин-2; 3-этилпентен-2.
2.Укажите валентный угол, тип гибридизации углерода, общую формулу алкенов.
3.Выбери из этого списка формулы алканов:
C6H14, C8H16, C6H6, C3H6, C2H6O, C12H22O11, C5H12, C7H12.
4.Напишите уравнения реакций. Дайте названия получившимся веществам.
а) гидрирование пропена;
б) горение ацетилена;
в) бромирование пропина (первая стадия).
________________________________ ____________________________________________
Самостоятельная работа.
Тема: Алканы, алкены, алкины. II вариант.
1.Составьте структурные формулы следующих веществ:
2,5 – диметилгексин-3; 3,3- диметилбутен-1.
2.Укажите валентный угол, тип гибридизации углерода, общую формулу алканов.
3.Выбери из этого списка формулы алкенов:
C3H4, C6H14, C8H16, C6H6, C3H6, C2H4O2, C6H12, C4H6.
4.Напишите уравнения реакций. Дайте названия получившимся веществам.
а) гидрирование этилена;
б) горение пропена;
в) хлорирование этана (первая стадия).
____________________________________________ ______________
Рекомендуемая литература.
Для студентов обязательная литература.
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2015.
Габриелян О.С. Общая химия: учеб. для 11 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, С.Н. Соловьев, Ф.Н. Маскаев – М., 2016.
Дополнительная литература.
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова – М., 2017.
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. – М., 2014
Габриелян О.С., Воловик В.В. Единый государственный экзамен: Химия: Сб. заданий и упражнений. – М., 2019.
Для преподавателей.
Габриелян О.С. Химия для преподавателя: учебно-методическое пособие / О.С. Габриелян, Г.Г. Лысова – М., 2016.
Габриелян О.С. Настольная книга учителя химии: 10 класс / О.С. Габриелян, И.Г. Остроумов – М., 2015.
Габриелян О.С. Лысова Г.Г. Химия для преподавателя: методическое пособие. – М., 2015.
11
Подтверждение авторства
Пожалуйста, введите ваш Email.
Если вы хотите увидеть все свои работы, то вам необходимо войти или зарегистрироваться
Полезное для учителя
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт